1. 1 ความปลอดภัยในการทำงานกับสารเคมี
การทำปฏิบัติการเคมีส่วนใหญ่ต้องมีความเกี่ยวข้องกับสารเคมี อุปกรณ์และเครื่องมือต่าง ๆ ซึ่งผู้ทำปฏิบัติการต้องตระหนักถึงความปลอดภัยของตนเอง ผู้อื่นและสิ่งแวดล้อมโดยผู้ทำปฏิบัติการควรทราบเกี่ยวกับประเภทของสารเคมีที่ใช้ ข้อควรปฏิบัติในการทำปฏิบัติการเคมี และการกำจัดสารเคมีที่ใช้แล้วหลังเสร็จสิ้นปฏิบัติการเพื่อให้สามารถท้าปฏิบัติการเคมีได้อย่างปลอดภัย
11. 1 ประเภทของสารเคมี
สารเคมีมีหลายประเภทแต่ละประเภทมีสมบัติแตกต่างกันสารเคมีจึงจำเป็นต้องมีฉลากที่มีข้อมูลเกี่ยวกับความเป็นอันตรายของสารเคมีเพื่อความปลอดภัยในการจัดเก็บการนำไปใช้และการาจัดโตยฉลากของสารเคมีที่ใช้ในห้องปฏิบัติการควรมีข้อมูลดังนี้
1. ชื่อผลิตภัณฑ์
2 รูปสัญลักษณ์แสดงความเป็นอันตรายของสารเคมี
3. คำเตือนข้อมูลความเป็นอันตรายและข้อควรระวัง
4. ข้อมูลของบริษัทผู้ผลิตสารเคมี
บนฉลากบรรจุภัณฑ์มีสัญลักษณ์แสดงความเป็นอันตรายที่สื่อความหมายได้ชัดเจนเพื่อให้ผู้ใช้สังเกตได้ง่ายสัญลักษณ์แสดงความเป็นอันตรายมีหลายระบบในที่นี้จะกล่าวถึง 2 ระบบที่มีการใช้กันอย่างแพร่หลายคือ Globally Harmonized System of Classification and Labeling of Chemicals (GMS) ซึ่งเป็นระบบที่ใช้สากลและ National Fire Protection Association Hazard Identification System (INFPA) เป็นระบบที่ใช้ในสหรัฐอเมริกาซึ่งสัญลักษณ์ทั้งสองระบบนี้สามารถพบเห็นได้ทั่วไปบนบรรจุภัณฑ์สารเคมีในระบบ GIS จะแสดงสัญลักษณ์ในสี่เหลี่ยมกรอบสีแดงพื้นสีขาวลักษณะดังรูป
สำหรับสัญลักษณ์แสดงความเป็นอันตรายในระบบ NFPA จะใช้สีแทนความเป็นอันตรายในด้านต่าง ๆ ได้แก่ สีแดงแทนความไวไฟสีน้ำเงินแทนความเป็นอันตรายต่อสุขภาพสีเหลืองแทนความว่องไวในการเกิดปฏิกิริยาเคมีโดยใส่ตัวเลข 0 ถึง 4 เพื่อระบุระดับความเป็นอันตรายจากน้อยไปหามากและช่องสีขาวใช้ใส่อักษรหรือสัญลักษณ์ที่แสดงสมบัติที่เป็นอันตรายต้านอื่น ๆ ดังตัวอย่างในรูป 1. 3
1. 1. 2 ข้อควรปฏิบัติในการทำปฏิบัติ
การการท้าปฏิบัติการเคมีให้เกิดความปลอดภัยผู้ทำปฏิบัติการควรทราบเกี่ยวกับการปฏิบัติตนเปทเกตความปลอดภัยนอกจากต้องทราบข้อมูลของสารเคมีที่ใช้แล้วนายวกับการปฏิบัติตนเองต้นทั้มก่อนระหว่างและหลังทำปฏิบัติการดังต่อไปนี้ปฏิบัติการให้เข้าใจวางแผนการทดลองหากมีข้อสงสัยต้อง
ก่อนทำปฏิบัติการ
1) ศึกษาบันตอนหรือวิธีการทำปฏิบัติการให้เข้าใจวางแผนการทดลอง A สอบถามครูผู้สอนก่อนที่จะทำการทดลอง
2) ศึกษาข้อมูลของสารเคมีที่ใช้ในการทดลองเทคนิคการใช้เครื่องมือวัสดุอุปกรณ์ตลอดจนวิธีการทดลองที่ถูกต้องและปลอดภัย
3) แต่งกายให้เหมาะสมเช่นสวมกางเกงหรือกระโปรงยาวสวมรองเท้ามิดชิดส้นเดียคนที่มีผมยาวควรรวบผมให้เรียบร้อยหลีกเลี่ยงการสวมใส่เครื่องประดับและคอนแทคเลนส์
ขณะทำปฏิบัติการ
1) ข้อปฏิบัติโดยทั่วไป
1. 1 สวมแว่นตานิรภัยสวมเสื้อคลุมปฏิบัติการที่ติดกระดุมทุกเม็ดควรสวมถุงมือเมื่อต้องใช้สารกัดกร่อนหรือสารที่มีอันตรายควรสวมผ้าปิดปากเมื่อต้องใช้สารเคมีที่มีไอระเหยและทำปฏิบัติการในที่ซึ่งมีอากาศถ่ายเทหรือในตู้ดูดควัน
1.2ห้ามรับประทานอาหารและเครื่องดื่มหรือทำกิจกรรมอื่นๆ ที่ไม่เกี่ยวข้องกับการทำปฏิบัตการ
1. 3 ไม่ทำการทดลองในห้องปฏิบัติการตามลำพังเพียงคนเดียวเพราะเมื่อเกิดอุบัติเหตุขึ้นจะไม่มีใครทราบและไม่อาจช่วยได้ทันท่วงทีหากเกิดอุบัติเหตุในห้องปฏิบัติการต้องแจ้งให้ครูผู้สอนทราบทันทีทุกครั้ง
1. 4 ไม่เล่นและไม่รบกวนผู้อื่นในขณะที่ทำปฏิบัติการ
1. 5 ปฏิบัติตามขั้นตอนและวิธีการอย่างเคร่งครัดไม่ทำการทดลองใด ๆ ที่นอกเหนือจากที่ได้รับมอบหมายและไม่เคลื่อนย้ายสารเคมีเครื่องมือและอุปกรณ์ส่วนกลางที่ต้องใช้ร่วมกันนอกจากได้รับอนุญาตจากตรผู้สอนเท่านั้น
1. 6 ไม่ปล่อยให้อุปกรณ์ให้ความร้อนเช่นตะเกียงแอลกอฮอล์เตาแผ่นให้ความร้อน (hot plate) ทำงานโดยไม่มีคนดูแลและหลังจากใช้งานเสร็จแล้วให้ตับตะเกียงแอลกอฮอล์หรือปิดเครื่องและถอดปลักไฟออกทันทีแล้วปล่อยไว้ให้เย็นก่อนการจัดเก็บเมื่อใช้เตาแผ่นให้ความร้อนต้องระวังไม่ให้สายไฟพาดบนอุปกรณ์
2) ข้อปฏิบัติในการใช้สารเคมี
2. 1 อ่านชื่อสารเคมีบนฉลากให้แน่ใจก่อนนำสารเคมีไปใช้
2. 2 การเคลื่อนย้ายการแปงและการถ่ายเทสารเคมีต้องทำด้วยความระมัดระวังโดยเฉพาะอย่างยิ่งสารอันตรายและควรใช้อุปกรณ์เช่นข้อนตักสารและปีกเกอร์ที่แห้งและสะอาดการเทของเหลวจากขวดบรรจุสารให้เทด้านตรงข้ามฉลากเพื่อป้องกันความเสียหายของฉลากเนื่องจากการสัมผัสสารเคมี
2. 3 การทำปฏิกิริยาของสารในหลอดทดลองต้องหันปากหลอดทดลองออกจากตัวเองและผู้อื่นเสมอ
2. 4 ห้ามซิมหรือสูดดมสารเคมีโดยตรงถ้าจำเป็นต้องทดสอบกลิ่นให้ใช้มือโบกให้ไอของสารเข้าจมูกเพียงเล็กน้อย
2. 5 การเจือจางกรตห้ามเหนองกรดแต่ให้เทกรดลงน้ำเพื่อให้น้ำปริมาณมากช่วยถ่ายเทความร้อนที่เกิดจากการละลาน
2. 6 ไม่เทสารเคมีที่เหลือจากการเทหรียตกออกจากขวดสารเคมีแล้วกลับเข้าขวดอย่างเด็ดขาดให้เทใส่ภาชนะทิ้งสารที่จัดเตรียมไว้
2. 7 เมื่อสารเคมีหกในปริมาเนเล็กน้อยให้กวาดหรือเข็ดแล้วทิ้งลงในภาชนะสำหรับทิ้งสารที่เตรียมไว้ในห้องปฏิบัติการหากหกในปริมาณมากให้แจ้งครูผู้สอน
หลังทำปฏิบัติการ
1) ทำความสะอาดอุปกรณ์เครื่องแก้วและวางหรือเก็บในบริเวณที่จัดเตรียมไว้ให้รวมทั้งทำความสะอาดโต๊ะทำปฏิบัติการ
2) ก่อนออกจากห้องปฏิบัติการให้ถอดอุปกรณ์ป้องกันอันตรายเช่นเสื้อคลุมปฏิบัติการแว่นตานิรภัยถุงมือ
1. 1. 3 การกำจัดสารเคมี
สารเคมีที่ใช้แล้วหรือเหลือใช้จากการทำปฏิบัติการให้เกิดความปลอดภัยต่อสิ่งแวดล้อมและสิ่งมีชีวิต
การกำจัดสารเคมีแต่ละประเภทสามารถปฏิบัติได้ดังนี้
1) สารเคมีที่เป็นของเหลวไม่อันตรายที่ละลายน้ำได้และมี pH เป็นกลางบวมสามารถเทลงอ่างน้ำและเปิดน้ำตามมาก ๆ ได้
2) สารละลายเข็มขันบางชนิดเช่นกรดไฮโดรคลอริกโซเดียมไฮดรอกไซด์ไม่ควรทิงลงอางนาหรือท่อน้ำทันทีควรเจือจางก่อนเทลงอ่างน้ำถ้ามีปริมาณมากต้องทำให้เป็นกลางก่อน
3) สารเคมีที่เป็นของแข็งไม่อันตรายปริมาณไม่เกิน 1 กิโลกรัมสามารถใส่ในภาชนะที่ปิดมิดชิดพร้อมทั้งติดฉลากชื่อให้ชัดเจนก่อนทิ้งในที่ซึ่งจัดเตรียมไว้
4) สารไวไฟตัวทำละลายที่ไม่ละลายน้ำสารประกอบของโลหะเป็นพิษหรือสารที่ทำปฏิกิริยากับน้ำห้ามทิ้งลงอ่างนๆให้ทิ้งไว้ในภาชนะที่ทางห้องปฏิบัติการจัดเตรียมไว้ให้
1.3 การวัดปริมาณสาร
ในการปฏิบัติการเคมีจำเป็นต้องมีการชั่ง ตวง วัดปริมาณสาร ซึ่งมีความคลาดเคลื่อนที่อาจเกิดจากอุปกรณืที่ใช้ หรือผู้ทำปฏิบัติการ ที่จะส่งผลให้การทดลองที่ได้มีค่าต่างจากค่าจริง
ความน่าเชื่อถือของข้อมูล พิจารณาได้จากความเที่ยงและความแม่นของข้อมูล คือความใกล้เคียงกันของค่าที่ได้จากการวัดซ้ำและความใกล้เคียงจากการวัดซ้ำเทียบกับค่าจริง โดยขึ้นอยู่กับทักษะของผู้ที่ทำการวัดและความละเอียดของอุปกรณ์ที่ใช้
1.3.1 อุปกรณ์วัดปริมาตร
บีกเกอร์ (beaker) - เป็นทรงกระบอกปากกว้าง มีขีดบอกปริมาตรในระดับมิลลิลิตร มีหลายขนาด
ขวดรูปกรวย (erlenmeyer flask) - คล้ายผลชมพู่ มีขีดบอกปริมาตรในระดับมิลลิลิตร มีหลายขนาด
กระบอกตวง (measuring cylinder) - ทรงกระบอก มีขีดบอกปริมาตรในระดับมิลลิลิตร มีหลายขนาด
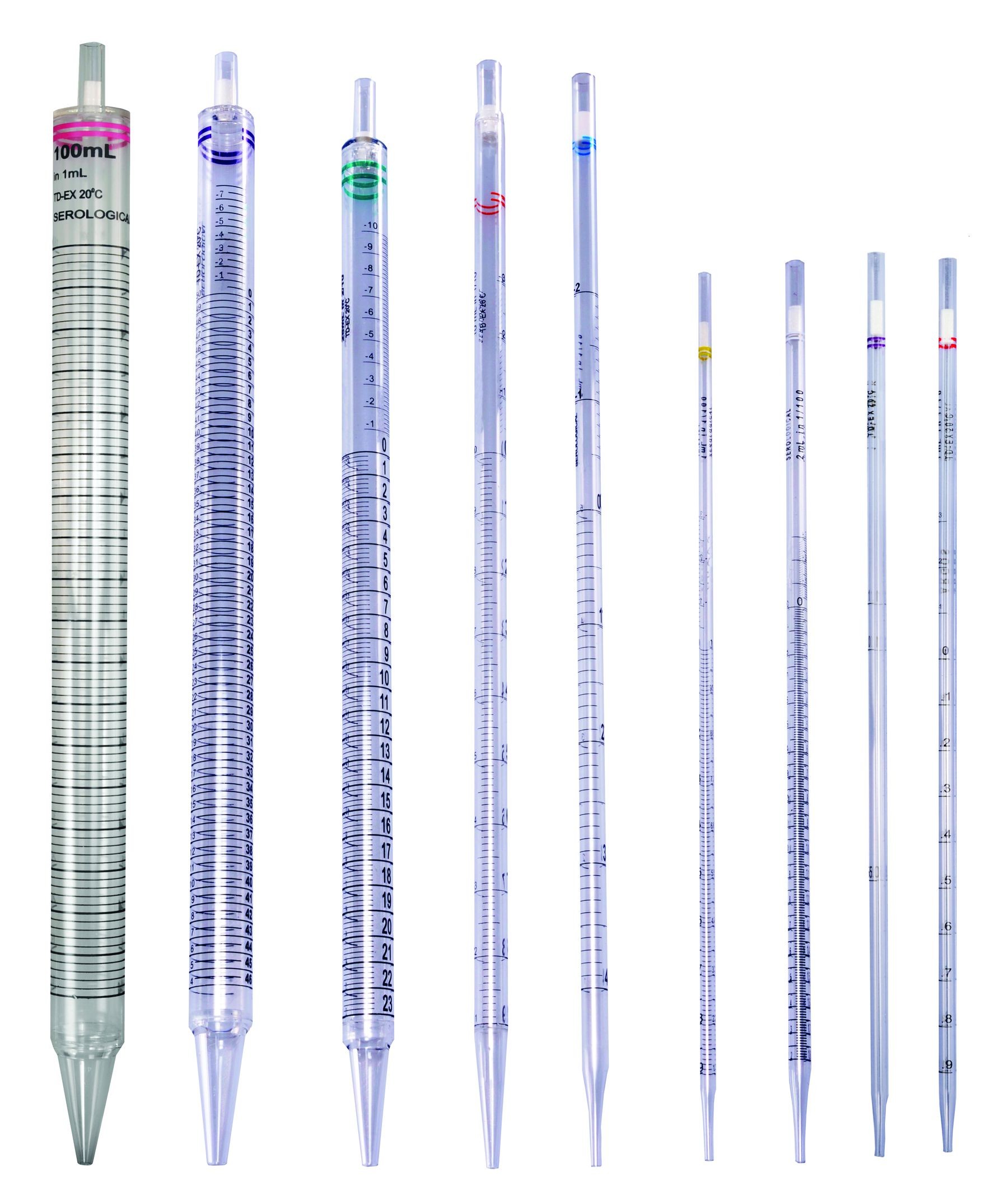
ปิเปตต์ (pipette) - เป็นอุปกรณ์วัดปริมาตรที่มีความแม่นสูง ใช้สำหรับถ่ายเทของเหลว มี 2 แบบ คือ แบบปริมาตรซึ่งมีกระเปาะตรงกลาง มีขีดบอกปริมาตรเพียงค่าเดียวและแบบใช้ตวง มีขีดบอกปรอมาตรหลายค่า
บิวเรตต์ (burette) - เป็นอุปกรณ์สำหรับถ่ายเทของเหลวในปริมาตรต่างๆตามต้องการ ลักษณะเป็นทรงกระบอกยาวที่มีขีดบอกปริมาตร และมีอุปกรณ์ควบคุมการไหลของของเหลวที่เรียกว่า ก๊อกปิดเปิด
ขวดกำหนดปริมาตร (volumetric flask) - เป็นอุปกรณ์สำหรับวัดปริมาตรของเหลวที่บรรจุภายใน ใช้สำหรับเตรียมสารละลายที่ต้องการความเข้มข้นแน่นอน มีขีดบอกปริมาตรเพียงขีดเดียว มีจุกปิดสนิท มีหลายขนาด
1.3.2 อุปกรณ์วัดมวล
เครื่องชั่ง เป็นอุปกรณ์สำหรับวัดมวลของสารทั้งที่เป็นของแข็งและของเหลว ความน่าเชื่อถือของค่ามวลที่วัดได้ขึ้นอยู่กับความละเอียดของเครื่องชั่งและวิธีการใช้เครื่องชั่ง ที่ใช้ในห้องปฏิบัติการเคมีโดยทั่วไปมี 2 แบบ คือ เครื่องชั่งแบบสามคานและเครื่องชั่งไฟฟ้า
เครื่องชั่งแบบสามคาน
เครื่องชั่งไฟฟ้า
1.3.3 เลขนัยสำคัญ
การนับเลขนัยสำคัญ มีหลักการดังนี้
- ตัวเลขที่ไม่มีเลข 0 ทั้งหมดนับเป็นเลขนัยสำคัญ
- 0 ที่อยู่ระหว่างตัวเลขอื่น นับเป็นเลขนัยสำคัญ
- 0 ที่อยู่หน้าตัวเลขอื่น ไม่นับเป็นเลขนัยสำคัญ
- 0 ที่อยู่อยู่หลังตัวเลขอื่นที่อยู่หลังทศนิยม นับเป็นเป็นเลขนัยสำคัญ
- 0 ที่อยู่หลังเลขอื่นที่ไม่มีทศนิยม อาจนับหรือไม่นับเป็นเลขนัยสำคัญก็ได้
- ตัวเลขที่แม่นตรงเป็นตัวเลขที่ซ้ำเข้าแน่นอนมีเลขนัยสำคัญเป็น อนันต์
- ข้อมูลที่มีค่าน้อยมากๆหรือเขียนในรูปของสัญกรณ์วิทยาศาสตร์ ตัวเลข สัมประสิทธิ์ ทุกตัวนับเป็นนัยสำคัญ
การปัดตัวเลข พิจารณาจากตัวเลขที่อยู่ถัดจากตำแหน่งที่ต้องการ ดังนี้
- กรณีที่ตัวเลขถัดจากตำแหน่งที่ต้องการมีค่าน้อยกว่า 5 ให้ตัดตัวเลขที่อยู่ถัดไปทั้งหมด
- กรณีที่ตัวเลขถัดจากตำแหน่งที่ต้องการมีค่ามากกว่า 5 ให้เพิ่มค่าของตัวเลขตำแหน่งสุดท้ายที่ต้องการอีก 1
- กรณีที่ตัวเลขถัดจากตำแหน่งที่ต้องการมีค่าเท่ากับ 5 และมีตัวเลขอื่นที่ไม่ใช่ 0 ต่อจากเลข 5 ให้เพิ่มค่าของตัวเลขตำแหน่งสุดท้ายที่ต้องการอีก 1
- กรณีที่ตัวเลขถัดจากตำแหน่งที่ต้องการมีค่าเท่ากับ 5 และไม่มีตัวเลขอื่นต่อจากเลข 5 ต้องพิจารณาตัวเลขที่อยู่ หน้าเลข 5 ดังนี้
4.1 หากตัวเลขที่อยู่หน้าเลข 5 เป็นเลขคี่ ให้ตัวเลขดังกล่าวบวกค่าค่าเพิ่มอีก 1 แล้วตัดตัวเลขตั้งแต่ 5 ลงไปทั้งหมดออก
4.2 หากตัวเลขที่อยู่หน้าเลข 5 เป็นเลขคู่ ให้ตัวเลขกล่าวเป็นตัวเลขเดิม แล้วตัดตัวเลขตั้งแต่ 5 ลงไปทั้งหมดออก
1.4 หน่วยวัด
1.4.1 หน่วยในระบบ SI
หน่วย SI พื้นฐาน มี 7 หน่วย ได้แก่
- มวล - กิโลกรัม (kg)
- ความยาว - เมตร (m)
- เวลา - วินาที (s)
- อุณหภูมิ - เคลวิน (K)
- ปริมาณของสาร - โมล (mol)
- กรพแสไฟฟ้า - แอมแปร์ (A)
- ความเข้มแห่งการส่องสว่าง - แคนเดลลา (cd)
หน่วย SI อนุพันธ์
- ปริมาตร - ลูกบาศก์เมตร (m³)
- ความเข้มข้น - โมลต่อลูกบาศก์เมตร (mol/m³)
- ความหนาแน่น - กิโลกรัมต่อลูกบาศก์เมตร (kg/m³)
หน่วยนอกระบบ SI เช่น ปริมาตร - ลิตร มวล - กรัม , ดอลตัน , หน่วยมวลอะตอม ความดัน - บาร์ , มิลลิเมตรปรอท , บรรยากาศ ฯลฯ
1.4.2 แฟกเตอร์เปลี่ยนหน่วย เป็นอัตราส่วนระหว่างหน่วยที่แตกต่างกัน 2 หน่วยที่มีปริมาณเท่ากัน
วิธีการเทียบหน่วย
ทำได้โดยการคุูณปริมาณในหน่วยเริ่มต้นด้วยแฟกเตอร์เปลี่ยนหน่วยที่มีหน่วยที่ต้องการอยู่ด้านบน ตามสมการ
ปริมาณและหน่วยที่ต้องการ = ปริมาณและหน่วยเริ่มต้น x หน่วยที่ต้องการ / หน่วยเริ่มต้น
1.5 วิธีการทางวิทยาศาสตร์
เป็นการศึกษาหาความรู้ทางวิทยาศสาตร์ที่มีแบบแผนขั้นตอน โดยภาพรวมทำได้ดังนี้- การสังเกต - อาศัยประสาทสัมผัะสทั้ง 5 โดยจะนำไปสู่ข้อสงสัยหรือตั้งคำถามที่ต้องการคำตอบ
- การตั้งสมมติฐาน - เป็นการคาดเดาคำตอบของคำถามหรือปัญหา โดยมีพื้นฐานจากการสังเกต ความรู้ หรือประสบการณ์เดิม
- การตรวจสอบสมมติฐาน - เป็นกระบวนการหาคำตอบของสมมติฐาน โดยมีการออกแบบการทดลองที่มีการควบคุมปัจจัยต่างๆ
- การรวบรวมข้อมูลและวิเคราะห์ผล - เป็นการนำข้อมูลที่ได้จากขั้นตอนทั้งหมดมารวบรวม วิเคราะห์ และอธิบายข้อเท็จจริง
- การสรุปผล - เป็นการสรุปความรู้หรือข้อเท็จจริงที่ได้จากการตรวจสอบสมมติฐานที่ตั้งไว้ก่อนหน้า

 กฎออกเตตใช้ได้ดีกับธาตุในคาบที่ 2 ของตารางธาตุ ซึ่งธาตุเหล่านั้นมีอิเล็กตรอนระดับนอกอยู่ใน 2s และ 2p ออร์บิทัล ซึ่งรับอิเล็กตรอนได้ไม่เกิน 8 อิเล็กตรอน
กฎออกเตตใช้ได้ดีกับธาตุในคาบที่ 2 ของตารางธาตุ ซึ่งธาตุเหล่านั้นมีอิเล็กตรอนระดับนอกอยู่ใน 2s และ 2p ออร์บิทัล ซึ่งรับอิเล็กตรอนได้ไม่เกิน 8 อิเล็กตรอน















(10).jpg)